Contenidos:
Una ecuación química es la representación escrita de una reacción química, que es el proceso en el que dos o más sustancias (reactivos) se combinan dando lugar a otras sustancias (productos).
En la siguiente reacción, \(A\) y \(B\) son los reactivos y \(C\) y \(D\) son los productos:
$$ A+B \rightarrow C+D$$
La ley de conservación de la masa establece que en una reacción química el número de cada tipo de átomos en los reactivos debe ser el mismo que en los productos.
En la siguiente ecuación química se representa la reacción del nitrógeno e hidrogeno para dar lugar a amoníaco:
$$ \mathrm{N_2 + H_2 \rightarrow NH_3}$$
En esta ecuación se representan 2 átomos de nitrógeno y 2 de hidrógeno en los reactivos, pero 1 átomo de nitrógeno y 3 de hidrógeno en el producto. Esta relación entre el número de átomos de los reactivos y productos no es acorde a la ley de conservación de la masa.
Para que la ecuación cumpla dicha ley, debemos escribir los coeficientes estequiométricos, que no son más que números (coeficientes) que indican la cantidad de cada molécula que interviene en la ecuación para conseguir que el número de átomos del mismo tipo coincida en ambos lados de la ecuación:
$$ \mathrm{N_2 + \color{red}3 H_2 \rightarrow \color{red}2 NH_3}$$
En esta ecuación, 1 molécula de nitrógeno y 2 de hidrógeno se combinan para dar lugar a 2 moléculas de amoníaco:
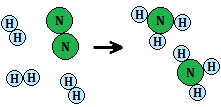
De este modo, el número de átomos de cada tipo coincide:

El método de tanteo para ajustar una reacción química consiste en ir probando coeficientes basándonos en nuestra intuición. Este método es útil cuando se trata de ecuaciones sencillas. Por ejemplo, vamos a ajustar la siguiente ecuación:
$$ \mathrm{ H_2 + O_2 \rightarrow H_2O}$$
La ecuación no está ajustada puesto que hay 2 átomos de oxígeno en los reactivos, pero sólo 1 en los productos. Si escribimos un 2 en los reactivos, el número de átomos coincide:
$$ \mathrm{ H_2 + O_2 \rightarrow \color{red}2 H_2O}$$
Sin embargo, el número de átomos de hidrógeno no coincide: 2 en reactivos y 4 en productos. Este problema se soluciona escribiendo un 2 en los reactivos:
$$ \mathrm{ \color{red}2 H_2 + O_2 \rightarrow \color{red}2 H_2O}$$
Ahora, el número de átomos sí coincide:

En muchas ocasiones, no es fácil ajustar una ecuación por el método de tanteo. Aunque sea más laborioso, el método de los coeficientes indeterminados es un procedimiento que asegura hallar los coeficientes estequiométricos.
Los pasos de este método son:
Veamos un ejemplo:
$$ \mathrm{Na_2CO_3 + HCl \rightarrow NaCl + CO_2 + H_2O}$$
Añadimos los coeficientes indeterminados (incógnitas):
$$ \mathrm{\color{red}a Na_2CO_3 + \color{red}b HCl \rightarrow \color{red}c NaCl + \color{red}d CO_2 + \color{red}e H_2O}$$
Tenemos 5 incógnitas: \(a\), \(b\), \(c\), \(d\) y \(e\). Como tenemos 5 tipos de átomos (\(\text{Na}\), \(\text{C}\), \(\text{O}\), \(\text{H}\) y \(\text{Cl}\)), obtendremos 5 ecuaciones.
Escribimos una tabla con el número de átomos del mismo tipo en ambos lados de la ecuación (teniendo en cuenta el coeficiente):

Las ecuaciones se obtienen igualando las columnas:
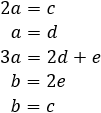
Tenemos varias formas de resolver. Supongamos que \(c=2\), entonces:
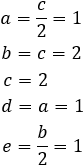
Sustituimos y ya tenemos ajustada la ecuación:
$$ \mathrm{Na_2CO_3 + \color{red}2 HCl \rightarrow \color{red}2 NaCl + CO_2 + H_2O}$$
Comprobamos:
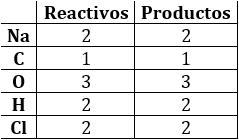
Los coeficientes obtenidos son números enteros (si son fracciones, se pueden multiplicar todos ellos por el mínimo común múltiplo de los denominadores) y mínimos (si no lo son, se pueden dividir todos ellos entre el máximo común divisor).
$$ \mathrm{ FeS_2 \rightarrow Fe_3S_4 + S_2} $$
$$ \mathrm{SO_2 + O_2 \rightarrow SO_3}$$
$$ \mathrm{ Fe_2O_3 + CO \rightarrow CO_2 + Fe}$$
$$ \mathrm{Cr_2O_3 + Al \rightarrow Al_2O_3 + Cr}$$
$$ \mathrm{Na_2CO_3 + H_2O + CO_2\rightarrow NaHCO_3}$$
$$ \mathrm{HCl + MnO_2 \rightarrow MnCl_2 + H_2O + Cl_2}$$
$$ \mathrm{Zn + AgNO_3 \rightarrow Zn(NO_3)_2 + Ag}$$
$$ \mathrm{C_6H_5COOH + O_2 \rightarrow CO_2 + H_2O}$$
$$ \mathrm{Fe + Cl_2 \rightarrow FeCl_3}$$
$$\mathrm{Ag + HNO_3 \rightarrow NO + H_2O + AgNO_3}$$
$$ \mathrm{CH_4 + O_2 \rightarrow CO_2 + H_2O}$$
$$ \mathrm{HCl + Al(OH)_3 \rightarrow AlCl_3 + H_2O}$$
$$ \mathrm{S + HNO_3 \rightarrow H_2SO_4 + NO_2 + H_2O}$$
$$ \mathrm{Cu + HNO_3 \rightarrow Cu(NO_3)_2 + NO + H_2O}$$
$$ \mathrm{KMnO_4 + Na_2SO_3 + H_2O \rightarrow MnO_2 + Na_2SO_4 + KOH}$$
Ajuste de ecuaciones químicas (estequiometría) - © - testexamen.com

Testexamen.com
by J. Llopis is licensed under a
Creative
Commons Attribution-NonCommercial 4.0 International License.