Explicamos los conceptos de disolución, disolvente, soluto y concentración y proporcionamos distintas formas (fórmulas) de expresar la concentración de una disolución (porcentajes, molaridad y molalidad). También, resolvemos algunos problemas sobre concentraciones.
Índice:
Temas relacionados:
Una disolución es una mezcla homogénea de dos o más sustancias. La mezcla es homogénea porque no se pueden distinguir sus componentes, la composición es uniforme y cada parte de la mezcla tiene las mismas propiedades.
Ejemplos:

Obsérvese que en la fotografía se distinguen claramente los dos componentes de la mezcla (el agua, abajo; y el aceite, arriba).
En una disolución de dos componentes:
Por ejemplo, en una disolución de 10ml de agua destilada y 5ml de alcohol, el agua es el disolvente y el alcohol es el soluto.
El disolvente es el que determina el estado físico (líquido, sólido o gaseoso) de la mezcla.
La mayoría de las disoluciones que se realizan en el laboratorio son líquido-líquido y sólido-líquido.
La concentración es la proporción que hay entre la cantidad de soluto y la de disolvente. Existen varias formas de expresar las concentraciones:
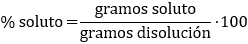
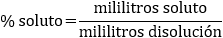
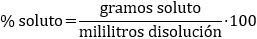
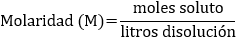
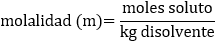
En el caso de los porcentajes, se han utilizado gramos y mililitros, pero pueden usarse otras unidades de masa. Sin embargo, la molaridad debe ser moles/litros y la molalidad debe ser moles/kg.
Fórmula que relaciona masa, peso molecular y moles:
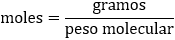
Se disuelven 30 gramos de cloruro sódico (NaCl) en 60 gramos de agua (H2O). Calcular la concentración en porcentaje.
Se disuelven 2 gramos de sal y 1 gramo de azúcar en 20 gramos de agua. Calcular el porcentaje de masa de cada soluto de la disolución.
Calcular cuánta sal se necesita para preparar 50 gramos de disolución (con agua) al 5%.
Se dispone de 20mL de una disolución de agua que tiene 3.8 gramos de sal. ¿Cuál es su concentración?
Calcular cuántos moles de NaCl se necesitan para preparar una disolución 0.1M. ¿Cuánto es gramos?
Dato: el peso molecular del NaCl es 58.5.
Calcular el volumen de disolución 0.2M que se obtiene con 100 gramos de nitrato de plata.
Dato: el peso molecular del nitrato de plata es 169.87.
Calcular la molalidad (m) de una disolución elaborada con 4 kg de agua y 80 gramos de sosa cáustica.
Dato: el peso molecular de la sosa cáustica es 40.
Disolución: concentración- © - testexamen.com

Testexamen.com
by J. Llopis is licensed under a
Creative
Commons Attribution-NonCommercial 4.0 International License.